2İstanbul Üniversitesi, Onkoloji Enstitüsü, Tıbbi Radyofizik Bilim Dalı, İstanbul
3İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi, Nükleer Tıp Anabilim Dalı, İstanbul
Summary
Pozitron emisyon tomografi (PET), insan vücudundaki organlar ve metabolizmaların görüntülenmesini sağlayan bir radyoizotop görüntüleme tekniğidir. Görüntüleme ilkesi olarak pozitronun-elektron yok olma olayı sonucunda ortaya çıkan iki adet 511 KeV enerjili yok olma fotonun eş zamanlı deteksiyonu kullanılmaktadır. Uygulamada C-11, N-13, O-15, F-18 gibi pozitron yayınlayan radyoizotopların glikoz molekülü ile birleştirilmesi sonucu elde edilen radyofarmasötik (örneğin; F-18-FDG) hastaya kan yolu ile verilir. Vücuttaki anormal yapılarda biriken bu radyofarmasötikten elde edilen 511 KeV fotonları PET cihazında algılanarak bilgisayarda vücudun 3-boyutlu görüntüsü elde edilmektedir. Bu yazıda, PET'in temel çalışma ilkesi, PET sintilasyon kristalleri, PET radyoizotopları ve radyoterapi tedavi planlamada PET hakkında bilgiler verilecektir.Introduction
1. GirişYetmişli yılların başlarında Hounsfield ve ark.[1] ilk bilgisayarlı tomografi görüntüsünü elde etmeyi başardılar. Yine bu dönemlerde pozitronelektron yok olmasından kaynaklanan 511 KeV fotonlarının kullanımı ile bir nesnenin 3-boyutlu bir görüntüsünün elde edilebilmesi fikri ortaya çıkınca, çeşitli pozitron emisyon tomografi (PET) cihazı denemeleri yapıldı ve günümüzde bilinen PET prensiplerinin temeli Phelps ve Hoffman’ın[2] 1974’lerin sonlarında insan çalışmaları için 48 NaI(Tl) detektörden oluşan hekzagonal PET III’ü geliştirmeleri ile atılmış oldu. Temel prensiplerinde bir değişiklik olmamakla beraber son zamanlarda özellikle PET sintilasyon kristallerinin etkinliği açısından çok önemli ilerlemeler kaydedilmiştir.[3],[4] Günümüz modern PET’leri dairesel olarak yerleştirilmiş birkaç sıra sintilatör halkası ve bu kristallere birleştirilmiş foton çoğaltıcı tüplerden (PMT) oluşmuştur (Şekil 1). Kullanılan sintilatör materyalleri vücuttan yayınlanan fotonları detekte edecek özelliklerde malzemelerdir.[5] Ayrıca bu detektörler arasında kurulan çeşitli elektronik üniteler sayesinde yayınlanan fotonların eş zamanlı deteksiyonu sağlanabilmektedir. Sistemde detektörler tarafından toplanan verilerden faydalanılarak görüntünün 3-boyutlu olarak oluşturulmasını sağlamak için yüksek işlem kapasiteli bir bilgisayar da bulunmaktadır.
Sekil 1: Üç sıra halka şeklinde dizili PET blok detektörleri ve hastanın görüntüleme pozisyonu.
PET, pozitron emisyonu ile bozunan radyonüklidlerden elde edilen pozitronun, ortamdaki bir elektronla birleşerek yok olması ile ortaya çıkan iki adet 511 KeV’lik yok olma fotonunun eşzamanlı deteksiyonu prensibine dayanan bir sistemidir. Böylece karşılıklı olarak etkileşim halinde bulunan detektörlerden iki tanesi belli bir zaman aralığı içinde gama fotonu alırsa sistem bir adet sayım kaydetmektedir. Bu şekilde dairesel olarak yerleştirilen sintilatör kristalleri vücudun çeşitli bölgelerinde toplanan radyoizotoplardan elde edilen farklı yoğunlukta ki 511 KeV’lik gamma fotonlarının hasta içindeki orijinlerini bilgisayar sistemine kayıt eder. Daha sonra yeniden yapılandırma işlemi ile bu sayısal veriler görüntüye çevrilmektedir.
PET’de gama kameralardaki gibi fiziksel bir kolimatör bulunmamaktadır ve kolimasyon işlemi elektronik olarak yapılmaktadır. Bundan dolayı kolimatörlerden kaynaklanan saçılmalar yok edilerek görüntü kalitesini arttırılmakta, böylece gama kameralarda 10-15 mm olan uzaysal rezolüsyon PET’de 4-5 mm’ye kadar inmektedir. Birçok klinik uygulamada PET gama kameralara göre önemli üstünlükler taşımaktadır. Elde edilen görüntülerle birçok kanser türünün saptaması yapıla bilirken, bazı organlardaki fonksiyon kayıpları ve değişimlerinin tespiti ile birçok hastalıkta erken evrelerde saptanabilmektedir.
Bu yazıda, PET’in temel çalışma ilkesi, PET sintilasyon kristalleri, PET radyoizotopları ve radyoterapi tedavi planlamada PET hakkında bilgiler verilecektir.
2. Pozitron Bozunumu ve Elektron-Pozitron Yok-olması
Nükleer karalılık eğrisinin üstünde yer alan çekirdekler
proton yönünden fazlalığı olan çekirdeklerdir.
Bu çekirdekler proton fazlalığından kurtularak
kararlı hale geçme eğilimindedirler. Proton
yönünden fazlalığı olan bu tür çekirdekler atom
numarası 40 olana kadar görülebilmektedirler. Bu
çekirdeklerin proton fazlalığından kurtulmalarının
yollarından biri elektron yakalama olayı, diğeri
çekirdeğin pozitron emisyonu ile bozunmasıdır.
Elektron yakalama olasılığı, pozitron emisyonu
olasılığına göre daha düşüktür. Pozitron emisyonunda
bir proton nötrona dönüşürken, ortama pozitif
yüklü bir elektron (β+; pozitron) ve bir adet
nötrino (υ) salınır. Reaksiyonda ortaya çıkan nötrino
hemen hemen kütlesiz olarak kabul edilen ve
diğer parçacıklarla çok zayıf etkileşime giren yüksüz
bir parçacıktır. Bozunum sonunda ortaya çıkan yeni çekirdeğin atom numarası ana çekirdeğe
göre bir azalırken kütle numarası aynı kalır.[6] Bozunumum
denklemi aşağıdaki gibidir.
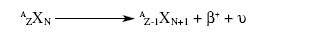
Burada A; Kütle numarası (proton + nötron sayısı), Z; Atom numarası (proton sayısı), N; Nötron
sayısı, β+; pozitron, υ; nötrino’dur.
Pozitron emisyonunda ortaya çıkan pozitronun ömrü çok kısadır ve enerjisine bağlı olarak ortamda 2-7 mm ilerledikten sonra ortamdaki bir elektronlar birleşerek yok olur.[7] Yok-olma olayından sonra elektron ve pozitron, E=mc2 formülüne göre sahip oldukları kütlelerin enerji eşdeğeri olan 511 KeV enerjili iki fotona dönüşürler. Bu fotonlar momentumun korunumu ilkesi gereğince bir birlerine 180°±0.25° açı ile zıt yönde yayınlanırlar. Bu olaya annihilasyon olayı (yok olma), oluşan fotonlara da yok-olma fotonları denir (Şekil 2).
3. PET’in Çalışma İlkesi; Yok-olma Fotonlarının Eş Zamanlı Deteksiyonu
Pozitron emisyonunda orta çıkan iki foton eş
zamanlı olarak yayınlanmaktadır. Bu fotonların eş
zamanlı deteksiyonu PET’de görüntülemenin temel
prensibini oluşturmaktadır. PET, çok kısa bir
zaman farklılığı (koinsidens zamanlama penceresi
= 6-12 nsn) içinde aynı yok olma olayından kaynaklanan
yok olma fotonlarını algılamak için dairesel
olarak yerleştirilmiş birçok detektörden
oluşmuştur. Görüntülenmesi istenilen nesnenin
farklı bölgelerinde oluşan 511 KeV enerjili foton
çiftleri halka şeklinde konumlandırılmış bu detektörler
tarafından algılandıktan sonra, bu verilerden
yararlanılarak bilgisayar aracılığı ile nesnenin 3-boyutlu görüntüsü yaratılmaktadır. Burada önemli
olan nokta 180° zıt yönde yerleştirilmiş olan detektörlere
gelen fotonların aynı yok olma olayından
kaynaklandığının doğru tespit edilmesidir.
Aynı yok olma olayından kaynaklanan iki 511 KeV yok olma fotonunun, herhangi iki detektör tarafından aynı koinsidens zaman penceresi içinde algılanmasına çakışma olayı (koinsidens) denilmektedir. Bu durumda sistem bir adet sayım kaydetmektedir (Şekil 3).
Yok-olma fotonların doku dışına çıkarken yolları üzerindeki atomlarla etkileşmeleri durumunda doğrusal yörüngelerinden saparlar ve enerji kaybedebilirler. Ya da bu fotonların üst üste binmeleri ile 511 KeV’den daha yüksek enerjili fotonlar ortaya çıkabilir. Bu durumda 250-650 KeV gibi bir aralıktaki tüm fotonlar gerçek koinsidens olarak algılanabilirler. Bunlar da görüntü rezolüsyonunu bozarlar. Öte yandan koinsidens kaydı için tam olarak eş zamanlı deteksiyonu aranmaz. Bunun yerine çok kısa zaman aralığında 6-12 ns gibi çok kısa zaman aralığında koinsidens kaydına izin verilir. Bunun kullanılmasının nedenleri, i) Hastanın tam merkezde oluşmayan yok olma fotonlarının detektöre varış zamanlarının farklı olması, ii) Gelen sinyal pulslarının detektör elektroniğindeki geçişine ve işlenmesine zaman tanımasının gerekmesi, iii) Kullanılan sintilasyon detektörlerinden gelen ışık sinyalinin hemen anında oluşmaması ve sintilasyon dikey zamanı (10-100 ns) denen bir zaman aralığı gerektirmesidir.
4. PET Sintilasyon Detektörleri
Sintilasyon detektörleri nükleer tıp da görüntülemede
çok yaygın olarak kullanılan detektör tiplerindendir.
Sodyum Iyodür [NaI(Tl)] sintilasyon
kristali 1958 yılından bu yana geleneksel gama
kameralarda yaygın olarak kullanılmaktadır.[8] Na-I(Tl) kristali nükleer tıp da görüntüleme amacıyla
yaygın olarak kullanılan ve 140 KeV enerjiye sahip
meta-stabil teknesyum (99mTc) radyoizotopu
için oldukça uygun olmasına karşın, 511 KeV gibi
nispeten daha yüksek enerjili yok olma fotonlarında özellikle durdurma gücü açısından uygun
olamamaktadır.[9] Bu nedenle PET’in ilk dönemlerinde
NaI(Tl) kristali kullanılırken daha sonraki
dönemlerde PET için daha etkin sintilasyon malzemeleri
üretilmiştir.
Sintilasyon kristallerinin ortak temel özellikleri gama ışını ile etkileştiklerinde görülebilir ışık (sintilasyon fotonu) oluşturmalarıdır. Oluşan sintilasyon fotonları foto-detektörde tespit edilir ve foton çoğaltıcı tüpler (PMT) yardımıyla elektronik ortamda akım sinyallerine çevrilirler. Kristalde oluşan sintilasyon yoğunluğu kristal içinde biriken enerji ile orantılıdır. Bundan dolayı PET’de yüksek atom numaralı ve dolayısı ile yoğun materyaller kullanılır.
Aşağıda PET için ideal bir sintilatör detektörünün taşıması gereken bazı özellikler verilmiştir.
1. Detektöre gelen gama fotonunun kinetik enerjisini yüksek bir verimlilikle ışık fotonlarına çevirebilmelidir.
2. Radyasyon-sintilasyon fotonu verimi lineer olmalıdır. Işık verimi yükseldikçe hem uzaysal rezolüsyon hem de enerji rezolüsyonu artar.
3. Kristal kendi ışık fotonlarına karşı geçirgen olmalıdır. Böylece oluşan sintilasyon fotonlarının tamamı sayılabilir.
4. Yüksek sayım hızlarında gelen her fotonun işlenebilmesi için decay time’ın (bozunma zamanı) kısa olması gerekir. Bu sayede koinsidens zamanlama penceresi kısaltılarak random sayımların azaltılması ve görüntü kalitesinin arttırılması sağlanabilir.
5. Kristal uygun bir detektör yapılabilecek boyutlarda üretilebilecek fiziksel özelliklere sahip ve ekonomik olarak uygun olmalıdır.
6. Kırılma indisi yaklaşık camın kırılma indisine (1.5) yakın olmalıdır. Böylece PMT ile kristal yüksek bir foton-elektron verimi ile birleştirilebilir.
7. İdeal bir PET detektörü, 511 KeV yok olma fotonlarına karşı yüksek durdurma gücüne sahip olmalıdır.
Yukarıdaki özelliklerin sahip günümüz PET detektörlerinde kullanılan bazı kristal tipleri;
1) Talyum karışımlı Sodyum İyot [NaI(Tl)]
2) Bizmut Germinat Oksit (BGO veya Bi4Ge3O12)
3) Seryum karışımlı Gadolinyum Oksiortosilikat (GSO veya Gd2SiO5:Ce)
4) Seryum karışımlı Lütesyum Oksiortosilikat (LSO veya Lu2SiO5:Ce)
5) Seryum karışımlı Lütesyum itriyum-alüminyuminat-perovsikat’tır ( LuYAP veya Lu0.7Y0.3 AP:Ce).
Tablo 1’de PET de yaygın olarak kullanılan bu sintilasyon kristallerinin bazı fiziksel özellikleri verilmiştir. Kısa decay time (40 nsn), yüksek foton verimi (25000 foton/ MeV), yüksek atom numarası (66), yüksek yoğunluk (7.4 cm3/gr) gibi iyi özellikleri LSO kristallerini 511 KeV yok olma fotonlarının deteksiyonu için ideal sintilasyon kristali yapmaktadır. Bu nedenle son dönemlerde üretilen birçok PET cihazında LSO kristalleri tercih edilmektedir.[8],[10],[11] Öte yandan bu günlerde LuYAP:Ce gibi Seryum karışımlı orto-aliminyuminatların kullanımıyla daha kısa decay time’lı çeşitli sintilasyon kristalleri üretilmeye başlanmış ve bunların PET detektörlerinde kullanılma çalışmaları da devam etmektedir.[5],[12]
Tablo 1: PET detektörlerinde yaygın olarak kullanılan bazı kristallerin fiziksel özellikleri
5. PET Radyoizotopları
PET radyoizotopları vücutta bulunan temel
elementler ile benzer biyokimyasal özellikler taşırlar. Bu radyoizotoplar düşük atom numaralı ve kısa yarı ömürlüdürler. PET radyoizotopları siklotronlarda[13] ya da lineer hızlandırıcılarda[14] yapay olarak üretilebilirler. Deneyler PET’de kullanılan dört pozitron yayınlayıcının (Oksijen-15O;
Azot-13N, Karbon-11C ve Flor-18F) 10-20 MeV
enerjili protonlar ve 5-15 MeV enerjili döteronlar
kullanılarak elde edilebileceğini göstermiştir.[15],[16]
Klinikte kullanılış amacına uygun bazı biyolojikkimyasal
sentezlere maruz bırakılan bu radyoizotoplar,
bu işlem sonucunda uygun bir biyomolekülle
birleştirilmek suretiyle radyofarmasötik haline
getirilmektedir.[17],[18] Ancak 11C, 13N ve 15O radyoizotoplarını kısa yarı ömürleri nedeniyle uzak
mesafelerden PET merkezlerine taşınmaları kolay
olmamaktadır. Bu nedenle 15O, 13N, 11C radyoizotopları
ile çalışılan merkezler üretim için kullanılan siklotronların yakınında kurulmak zorundadır.
Oysa 18F radyoizotopu diğerlerine göre daha uzun
bir yarı ömre sahiptir (110 dakika) ve bunların belirli
mesafelerdeki merkezlere taşınması mümkün
olabilmektedir. Tablo 2’de PET’de yaygın olarak
kullanılan radyoizotopların bazı fiziksel özellikleri
verilmiştir.
Tablo 2: PET’de yaygın olarak kullanılan bazı radyoizotoplar ve özellikleri
6. Pozitron Emisyon Tomografi ve Radyoterapi Tedavi Planlama
Radyoterapide amaç sağlıklı dokuyu korurken,
hastalıklı dokuyu da yeterli radyasyon dozu ile
ışınlamaktır. Bu amaca uygun bir radyoterapi
planlaması yapılmazsa, hem yeterli tümör kontrolü
sağlanamaz hem de sağlıklı dokuda istenilmeyen
erken ve geç etkiler ortaya çıkabilir. Bu nedenle
yayınlanan uluslararası çalışmalarda radyoterapi
planlaması açısından kritik volümler ayrıntılı olarak tanımlanmıştır.[19],[20] Bu yapılar tedavi
planlama bilgisayarlarında bilgisayarlı tomografi
(BT) ve manyetik rezonans görüntüleme (MRG)
gibi anatomik görüntüleme yöntemleri aracılığı ile
oluşturulmaktadır. Özellikle, BT teknolojisi radyoterapi
tedavi planlama sistemlerinde vazgeçilmez
bir önem taşımaktadır. Son dönemlerde BT
teknolojisinin oldukça gelişmiş olmasına rağmen,
yinede bazı durumlarda BT görüntüleri hastalıklı
yapıyı sağlam dokudan ayırt edecek kadar yeterli
kontrast oluşturamamaktadır. Bu durum radyoterapi
planlama için gerekli hedef volümlerinin tanımlanması açısından önemli bir engeldir.
Tıbbi görüntüleme de yaygın kullanım alanları bulan PET cihazları ile anormal anatomik yapıların vücut içerisindeki yerleri yüksek bir kesinlikle tespit edilebilmektedir. Özellikle kanser hastalıklarının tanısında çok önemli avantajlar sağlayan PET tekniği, akciğer kanseri,[21] kolon kanseri,[22] lenfoma,[23] malign melanom,[24] meme kanseri,[25] meme kanserinde aksillar lenf nodu evrelemesi,[26] baş-boyun kanserlerinin tanısı ve evrelemesinde,[27] serviks kanseri teşhisi,[28] bu kanserlerin radyoterapi veya kemoterapi sonrası tedaviye cevabının araştırılması konularında oldukça faydalı bilgiler sağlamaktadır. Bu tür cihazlarda 20-25 dakikalık kısa süreler içerisinde vücudun aynı şartlar altında PET ve BT görüntüleri ayrı ayrı elde edilebilmekte ve bunların üst üste çakıştırılmış görüntüleri bilgisayar ortamında kolaylıkla oluşturulabilmektedir (Şekil 4). Bu yönü ile PET/BT cihazları radyoterapi gibi tedavi planlama açısından tümör lokalizasyonun doğru tespit edilmesinin önemli olduğu tedavi modelleri için çok faydalı bilgiler sağlamaktadır. Anatomik detaylardan çok fonksiyonel ve metabolik aktiviteyi göstermeye yönelik olması açısından bu teknik, ultrasound, planar X ışını görüntülemesi, planar nükleer tıp görüntülemesi, BT ve MRG gibi geleneksel görüntüleme tekniklerinden ayrılmaktadır.[29] Biyolojik görüntüleme (ya da moleküler, fonksiyonel görüntüleme) olarak da adlandırılabilecek olan bu uygulamanın klinikteki en yaygın uygulama alanı vücuttaki glikoz metabolizmasının görüntülenmesi işlemidir. Bu işlemde en yaygın kullanılan biyokimyasal ajan ise Flor-18 ile işaretlenmiş glikozdan oluşan Fluoro-2-Deoxy-Glucose (18F-FDG) dir. PET görüntülerinin radyoterapi planlama bilgisayarlarına adaptasyonu ile artık BT, MRG gibi anatomik görüntüler ile PET’den elde edilen bu metabolik görüntüler beraber değerlendirilebilmektedir.[30]-[34] Tümörlerin metabolik olarak da görüntülenebilmelerinin sonucu olarak Ling ve ark.[34] radyoterapi planlamada kullanılan Gross Tümör Volümü (GTV), Klinik Target Volüm (CTV), Planlanan Target Volüm (PTV) kavramlarına ilave olarak Biyolojik Target Volüm (BTV) tanımlamasının da yapılabileceğini söylemişlerdir (Şekil 5). Bu yeni hedef tanımlaması, GTV olarak tanımlanan bölgenin içerisinde ayrı bir tümör volümünün (BTV) tanımlanabileceği bir durumu ifade etmek amacıyla oluşturulmuştur. Bu yeni tanımlama PET’in, tümörün vücut içindeki yerleşiminin doğru olarak tespitinde kullanımının yanında, aynı zamanda radyasyon onkoloğuna da Intensity Modulated Radiation Therapy (IMRT)[35] ile GTV’nin bazı bölgelerine daha yüksek doz uygulayabilme imkânı da sağlayabilmektedir.
Son dönem radyoterapi tedavi planlama bilgisayarları geleneksel görüntülene yöntemlerinin yanı sıra PET görüntülerinin de kullanılmasına olanak sağlayacak yazılımlar içermektedir. Yapılan çalışmalar yalnız başına X-ışını grafisi, BT, MRG gibi tekniklerle elde edilen anatomik görüntüler kullanılarak oluşturulan hedef volümlerin (GTV, CTV, PTV), PET ile beraber değerlendirilmesi durumunda önemli derece değişikliklere uğradığını göstermiştir. Aşağıda bu tür çalışmalara örnekler verilmiştir. Hebert ve ark.[36] küçük hücreli olmayan akciğer kanserinin volüm tanımlamaları için X-ışını grafisi, BT ve PET görüntülerini karşılaştırmalı olarak değerlendirdikleri çalışmalarında, PET görüntüleri dikkate alındığında çalışmaya alınan yirmi hastanın üçünün (%15) planlamada çizilen tümör volümlerinin büyütüldüğü, buna karşın dört hastanın (%20) ise planlamada çizilen tümör volümlerinin küçültüldüğü tespit edilmiştir. Daha fazla hastanın dahil edildiği bir başka çalışmada Mac Manus ve ark.[37] radikal radyoterapi uygulanan 102 hastanın BT ve PET görüntülerini yine karşılaştırmalı olarak değerlendirdiklerinde, PET sonuçlarının dikkate alınması durumunda 22 hastanın (%21) tümör volümlerinin büyütüldüğü, 16 hastanın (%15) GTV’lerinin ise küçüldüğünü saptamışlardır. PET’in akciğer tümörlerinin hedef volüm tanımlamalarına etkilerini inceleyen çalışmalar literatürde oldukça bol sayıda mevcuttur. Bu çalışmalar Greco ve ark.[38] ile Grosu ve ark.[39] derleme çalışmalarında detaylı olarak verilmiştir. Ciernik ve ark.[40] baş-boyun tümörleri içinde PET değerlendirmesi sonucunda benzer sonuçlar rapor etmişlerdir. Bu çalışmada GTV ve PTV tanımlasın için PET/BT ve yalnız BT görüntüleri ayrı ayrı kullanılmıştır. Çalışma sonunda PET/BT değerlendirmesi ile 12 hastanın 2’sinin (%17) GTV’leri %25 oranında büyütülürken, 12 hastanın 4 tanesinin de (%33) GTV’leri ise en az %25 oranında küçülmüştür.
PET görüntüleme tekniği diğer görüntüleme sistemlerine göre oldukça hassas çalışma ortamları gerektirmektedir. Partikül hızlandırıcıda H2O18 hedefinin protonlarla ışınlanması sonucunda [18]O (p,n) 18F reaksiyonu ile elde edilen 18Flor, fiziksel yarı ömrü 109.8 dakika olan radyoaktif bir elementtir. Siklotronların otomatik sentez ünitesinde “SN2 Nucleophilic Değiştirme” yöntemine[41] göre elde edilen [18F]-Fluoro-2-Deoxy-Glucose [18F]-FDG), izotonik sodyum klorür içinde steril, berrak, renksiz veya hafif sarı renkli, damar yolu ile uygulanmaya hazır bir radyofarmasötiktir. Ticari olarak kurşun zırh içinde 20 ml’lik cam şişede multidoz olarak en az 1150 MBq (31 mCi) [18F]-FDG solüsyonu olarak üretilmektedir. Renksiz veya hafif sarı renkli berrak bir çözelti olan solüsyonun pH değeri 4.5-8.5 aralığındadır ve sterildir. 10-20 mCi dozlarında bir [18F]-FDG radyofarmasötiği intravenöz olarak hastaya uygulandıktan sonra, radyofarmasötiğin vücuduna yayılması için hasta yaklaşık 1 saatlik bir bekleme süresince dinlendirilir. Çekim öncesinde hastanın mesanesindeki idrarın boşaltılması ile hasta çekime hazırlanır. Ancak PET’te hasta görüntülenmeye başlanmadan önce hasta hazırlığı açısından dikkat edilmesi gereken en önemli konulardan birisi hastanın kan şeker seviyesinin uygunluğudur. Dokulardaki [18F]-FDG tutulumu beslenme ve şeker hastalığı ile bağlantılı kan şekeri düzeyinin değişkenliğine göre farklılık gösterebilir. Diyabet şikâyeti bulunmayan hastalar [18F]-FDG enjeksiyonu öncesinde beslenerek kan şekeri düzeyleri kararlı hale getirilmelidir. Diyabetik hastaların ise kan glikoz düzeylerinin [18F]-FDG taramasının öncesinde ve taramanın yapıldığı günde kararlı duruma getirilmesi gerekebilir. Çekim yapılacak gün hastadan kan alınarak kanındaki glikoz düzeyi kontrol edilir. 60-130 mg/dL aralığında olan değerler uygun kabul edilerek hastaya [18F]-FDG solüsyon damar yolu ile enjekte edilir. Bu şekilde yüksek bir tümör-vücut zemini kontrast oranı elde edilir ki, bu da radyoterapi planlama açısından oldukça ideal bir durumdur.
PET’de bir başka önemli problem de kilolarına göre hastaların enjeksiyon dozlarının ve görüntüleme sürelerinin doğru tespit edilmesidir. Doğru enjeksiyon dozları ve doğru çekim süreleri PET detektörlerinin yeterli sayım kaydetmesine imkan vererek, tümör ve vücut zemini arasında yüksek bir kontrast oranı sağlar. Bu yüksek kontrast oranıda yine radyoterapi planlamada GTV, CTV, PTV gibi yapıların sınırlarının doğru tespitine olanak sağlar.[42] PET’de diğer önemli bir problem de akciğer gibi organların çekim sırasında hareket etmeleri sonucunda tümör yerleşimi ve boyutlarında ortaya çıkabilecek hatalardır. Son dönem BT’lerin helikal yapıları BT çekim sürelerini birkaç dakikaya kadar indirmiştir. PET/BT ünitelerinde, elde edilen BT görüntüleri PET görüntüleri ile birleştirilmek suretiyle tümörlerin vücut içindeki yerlerinin yüksek bir kesinlikle tespiti amaçlanmaktadır. BT’nin aksine bir hastanın PET görüntülemesi ise 20-25 dakikalık sürelerde yapılabilmektedir. PET çekim sürelerinin uzun olması akciğer gibi hareketli organların tümörlerinin yerlerinin tespitinde belirsizlikler yaratmakta ve hatta boyutları açısından yanılgılara sebep olabilmektedir.[30],[43] İleride daha hızlı cevap sürelerine sahip sintilasyon malzemeleri imal edilmek suretiyle PET görüntüleme sürelerinin kısaltılması bu sorunun çözümüne yardımcı olabilir. Bu sorunun çözümüne yönelik diğer önemli bir yaklaşımda 4 boyutlu görüntüleme ile PET uygulamasıdır (respirator gated technique).[44],[45] Böyle bir uygulama, çekim sırasında hastanın üzerine yerleştirilen algılama sisteminin, odaya terleştirilen kamera yardımıyla takibi prensibine dayanmaktadır. Burada nefes almanın yarattığı olumsuzluklardan kurtulmak amacıyla, göğüs kafesinin hareketlerinin izin verilen sınırlar dışına çıkması durumunda, PET tarafından veri toplanmasının durdurulması amaçlanmıştır. Bu şekilde tümör sınırlarının daha keskin olarak ortaya çıkması ve tümörün gerçek boyutlarının elde edilmesi sağlanabilir.
7. Sonuç
PET/BT tekniği son dönemlerde nükleer tıp
alanında çok önemli bir dinamizme neden olmuş
ve bu görüntüleme tekniği yukarıda da bahsedildiği üzere özellikle kanser hastalığının tanısında çok
faydalı bilgiler sağlamaya başlamıştır. Önümüzdeki
yıllarda bu cihazların teknik özelliklerin ve sintilasyon
kristallerinin özelliklerinin verimlerini artırılması sayesinde görüntüleme sürelerinin daha
da kısalması ve daha detaylı görüntülerin elde
edilmesi beklenmektedir.
Sonuç olarak, PET radyoterapi açısından da;
1. Tümörlerin vücut içindeki tam yerleşimi neresidir?
2. Makroskobik tümör marjları nelerdir?
3. Görüntülenen tümörün biyolojik özellikleri nelerdir?
4. Radyoterapi sonrasında tedavinin etkinliği nedir?
Sorularının cevaplanmasında etkin olarak kullanılabilecek yararlı bir görüntüleme yöntemi olarak radyoterapide yer bulmaktadır.
References
1) Hounsfield GN. Computerized transverse axial scanning (tomography). 1. Description of system. Br J Radiol 1973;46(552):1016-22.
2) Phelps ME, Hoffman EJ, Mullani NA, Ter-Pogossian MM. Application of annihilation coincidence detection to transaxial reconstruction tomography. J Nucl Med 1975;16(3):210-24.
3) Humm JL, Rosenfeld A, Del Guerra A. From PET detectors to PET scanners. Eur J Nucl Med Mol Imaging 2003;30(11):1574-97.
4) Moses WW. Trends in PET Imaging. Nuclear Instruments and Methods in Physics Research A 2001;471:209-14.
5) Kuntner C, Auffray E, Bellotto D, Dujardin C, Grumbach N, Kamenskikh IA, et al. Advances in the scintillation performance of LuYAP:Ce single crystals. Nuclear Instruments and Methods in Physics Research A 2005;537:295-301.
6) Krane SK. Nükleer Fizik-I. Çeviri Editörü, Şarer B. Palme Yayıncılık: 2001. s. 174.
7) Levin SC, Hoffman E. Calculation of positron range and its effect on the fundamental limit of positron emission tomography system spatial resolution. Physics in Medicine and Biology 1999;44:781-99.
8) Lopes MI, Chepel V. Detectors for medical radioisotope imagine: demands and rerspectives. Radiation Physics and Chemistry 2004;71:683-92.
9) Demir M. Nükleer Tıp Fiziği. Bayrak Ofset Matbaacılık; İstanbul: 2008.
10) Melcher CL. Scintillation crystals for PET. J Nucl Med 2000;41(6):1051-5.
11) Ericsson L, Townsend D, Erikson M, Melcher C, Schmand M, Bendriem B, et al. Experience with scintillators for PET: Towards the fifth generation of PET scanners. Nuclear Instruments and Methods in Physics Research A 2004;525:242-8.
12) Trummera J, Auffraya E, Lecoqa P, Petrosyanb A, Sempere-Roldana P. Comparison of LuAP and LuYAP crystal properties from statistically significant batches produced with two different growth methods. Nuclear Instruments and Methods in Physics Research A 2005;551:339-51.
13) Saha GB, MacIntyre WJ, Go RT. Cyclotrons and positron emission tomography radiopharmaceuticals for clinical imaging. Semin Nucl Med 1992;22(3):150-61.
14) Volkovitsky P, Gilliam DM. Possible PET isotopes production using linear deuteron acceleretors. Nuclear Instruments and Methods in Physics Research A 2005;548:571-3.
15) Robert AD, Daniel LC, Nickles RJ. A high pover target for the production of [18F] fluoride. Nuclear Instruments and Methods in Physics Research B 1995;99:797-9.
16) Lagunas-Solar Manuel C, Carvacho OF. Cyclotron production of PET radionuclides: No-carrier-added Fluorine-18 with High-energy protons on natural neon gas targets. Appl Radiat Isot 1995;46(9):833-8.
17) Maiti DK, Chakraborty PK, Chugani DC, Muzik O, Mangner TJ, Chugani HT. Synthesis procedure for routine production of [carbonyl-11C]desmethyl-WAY-100635. Appl Radiat Isot 2005;62(5):721-7.
18) Schlyer DJ. PET tracers and radiochemistry. Ann Acad Med Singapore 2004;33(2):146-54.
19) International Commission on Radiation Units and Measurements (ICRU), Prescribing, Recording and Reporting Photon Beam Therapy (Report 50).
20) International Commission on Radiation Units and Measurements (ICRU), Prescribing, Recording and Reporting Photon Beam Therapy (Report 62).
21) Acker MR, Burrell SC. Utility of 18F-FDG PET in evaluating cancers of lung. J Nucl Med Technol 2005;33(2):69-74; quiz 75-7.
22) Delbeke D, Vitola JV, Sandler MP, Arildsen RC, Powers TA, Wright JK Jr, et al. Staging recurrent metastatic colorectal carcinoma with PET. J Nucl Med 1997;38(8):1196-201.
23) Hoh CK, Glaspy J, Rosen P, Dahlbom M, Lee SJ, Kunkel L, et al. Whole-body FDG-PET imaging for staging of Hodgkin’s disease and lymphoma. J Nucl Med 1997;38(3):343-8.
24) Steinert HC, Huch Böni RA, Buck A, Böni R, Berthold T, Marincek B, et al. Malignant melanoma: staging with whole-body positron emission tomography and 2-[F-18]-fluoro-2-deoxy-D-glucose. Radiology 1995;195(3):705-11.
25) Rosen EL, Eubank WB, Mankoff DA. FDG PET, PET/CT, and breast cancer imaging. Radiographics 2007;27 Suppl 1:S215-29.
26) Crippa F, Gerali A, Alessi A, Agresti R, Bombardieri E. FDG-PET for axillary lymph node staging in primary breast cancer. Eur J Nucl Med Mol Imaging 2004;31 Suppl 1:S97-102.
27) Lonneux M. Current applications and future developments of positron emission tomography in head and neck cancer. [Article in French] Cancer Radiother 2005;9(1):8-15. [Abstract]
28) Reinhardt MJ, Ehritt-Braun C, Vogelgesang D, Ihling C, Högerle S, Mix M, et al. Metastatic lymph nodes in patients with cervical cancer: detection with MR imaging and FDG PET. Radiology 2001;218(3):776-82.
29) Elliott A. Medical imaging. Nuclear Instruments and Methods in Physics Research A 2005;546:1-13.
30) Nestle U, Weber W, Hentschel M, Grosu AL. Biological imaging in radiation therapy: role of positron emission tomography. Phys Med Biol 2009;54(1):R1-25.
31) Bentzen SM. Radiation therapy: intensity modulated, image guided, biologically optimized and evidence based. Radiother Oncol 2005;77(3):227-30.
32) Bradley J, Thorstad WL, Mutic S, Miller TR, Dehdashti F, Siegel BA, et al. Impact of FDG-PET on radiation therapy volume delineation in non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2004;59(1):78-86.
33) Tanderup K, Olsen DR, Grau C. Dose painting: art or science? Radiother Oncol 2006;79(3):245-8.
34) Ling CC, Humm J, Larson S, Amols H, Fuks Z, Leibel S, et al. Towards multidimensional radiotherapy (MDCRT): biological imaging and biological conformality. Int J Radiat Oncol Biol Phys 2000;47(3):551-60.
35) Yu CX, Amies CJ, Svatos M. Planning and delivery of intensity-modulated radiation therapy. Med Phys 2008;35(12):5233-41.
36) Hebert ME, Lowe VJ, Hoffman JM, Patz EF, Anscher MS. Positron emission tomography in the pretreatment evaluation and follow-up of non-small cell lung cancer patients treated with radiotherapy: preliminary findings. Am J Clin Oncol 1996;19(4):416-21.
37) Mac Manus MP, Hicks RJ, Ball DL, Kalff V, Matthews JP, Salminen E, et al. F-18 fluorodeoxyglucose positron emission tomography staging in radical radiotherapy candidates with nonsmall cell lung carcinoma: powerful correlation with survival and high impact on treatment. Cancer 2001;92(4):886-95.
38) Greco C, Rosenzweig K, Cascini GL, Tamburrini O. Current status of PET/CT for tumour volume definition in radiotherapy treatment planning for non-small cell lung cancer (NSCLC). Lung Cancer 2007;57(2):125-34.
39) Grosu AL, Piert M, Weber WA, Jeremic B, Picchio M, Schratzenstaller U, et al. Positron emission tomography for radiation treatment planning. Strahlenther Onkol 2005;181(8):483-99.
40) Ciernik IF, Dizendorf E, Baumert BG, Reiner B, Burger C, Davis JB, et al. Radiation treatment planning with an integrated positron emission and computer tomography (PET/CT): a feasibility study. Int J Radiat Oncol Biol Phys 2003;57(3):853-63.
41) Gillies JM, Prenant C, Chimon GN, Smethurst GJ, Dekker BA, Zweit J. Microfluidic technology for PET radiochemistry. Appl Radiat Isot 2006;64(3):333-6.
42) Macapinlac HA. Clinical applications of positron emission tomography/computed tomography treatment planning. Semin Nucl Med 2008;38(2):137-40.
43) Halpern BS, Dahlbom M, Quon A, Schiepers C, Waldherr C, Silverman DH, et al. Impact of patient weight and emission scan duration on PET/CT image quality and lesion detectability. J Nucl Med 2004;45(5):797-801.





